Diccionario de enfermedades
Hemofilias
Las hemofilias son un grupo de enfermedades hereditarias caracterizadas por la ausencia de determinadas proteínas (factores de coagulación), necesarias para que la sangre coagule normalmente, desde el nacimiento. La carencia de estos factores de coagulación conlleva una tendencia al sangrado (hemorragias) ante pequeños golpes o incluso de forma espontánea. La gravedad es mayor o menor en función de si la falta de factores de coagulación es total o parcial (actividad residual).
Afecta a 1 de cada 10.000 varones de la población.
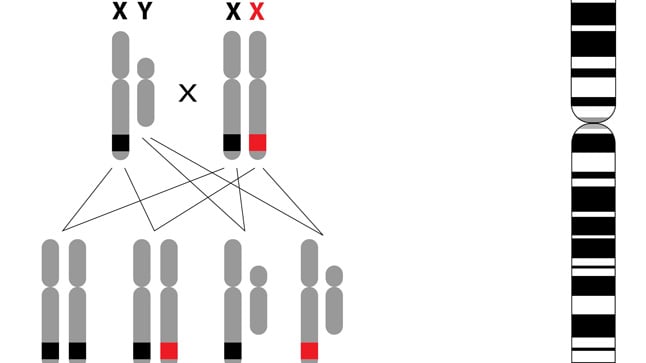
La hemofilia es una enfermedad hereditaria recesiva ligada al cromosoma X, es decir, el defecto genético se localiza en el cromosoma X. Dado que los varones (XY) solo tienen un cromosoma X, siempre desarrollarán la enfermedad si reciben de su madre un cromosoma X alterado. Por el contrario, si las mujeres (XX), reciben un único cromosoma X alterado (de su padre o de su madre) se convierten en portadoras pero no desarrollan la enfermedad. Si recibieran 2 cromosomas X alterados (uno del padre y otro de la madre) sí podrían desarrollar una hemofilia. Por este motivo la hemofilia es mucho más frecuente en los varones. Existen varios tipos de hemofilia:
Los síntomas de la hemofilia A y de la hemofilia B son indistinguibles. En función del tipo de mutación, la actividad residual de los factores VIII o IX puede ser mayor o menor. En este sentido la hemofilia puede clasificarse como:
La hemofilia se sospecha ante la presencia de alteraciones en la coagulación de la sangre al realizar pruebas rutinarias de coagulación (alargamiento del tiempo parcial de tromboplastina activado). Ante esos hallazgos se deben solicitar pruebas más complejas que evalúen la actividad de los factores VIII y IX de la coagulación.
La hemofilia es una enfermedad hereditaria recesiva ligada al cromosoma X. Esto significa que la padecen fundamentalmente los varones. Las mujeres solo pueden padecerla si heredan dos cromosomas X alterados (uno de la madre y otro del padre).
Un padre con hemofilia no trasmite nunca la enfermedad a sus hijos varones pero todas sus hijas serán portadoras de la enfermedad.
Una madre portadora del gen de la hemofilia transmitirá la hemofilia a la mitad de sus hijos varones y la mitad de sus hijas serán portadoras de la enfermedad.
La hemofilia no es una enfermedad contagiosa.
La identificación de múltiples mutaciones en los genes F8 y F9 permite estudiar qué mujeres de la familia son portadoras de la enfermedad y realizar recomendaciones en consecuencia.
El pronóstico de los pacientes con hemofilia ha mejorado mucho en las últimas décadas. Sin embargo, y como consecuencia de la administración de crioprecipitados procedentes de plasma humano hasta finales de los años 80, actualmente muchos pacientes están infectados por el VIH o por el virus de la hepatitis C, lo que influye de forma sustancial en su pronóstico. Las expectativas de vida en pacientes no infectados son discretamente menores a las de la población general si tienen formas graves de la enfermedad. En casos de enfermedad leve o moderada sus expectativas de vida no difieren de las de la población normal. Los pacientes con hemofilia padecen con frecuencia problemas degenerativos en las articulaciones, lo que conlleva dolor e invalidez.
Sin tratamiento, la hemofilia grave tiene un mal pronóstico.
Los primeros tratamientos consistieron en la infusión de plasma (es decir de sangre tras quitarle las células que viajan en ella) o de concentrados del plasma (crioprecipitados) obtenidos de donantes sanos. Estos tratamientos, sin embargo, fueron una fuente frecuente de infección tanto por el virus de la hepatitis C como por el virus de la inmunodeficiencia humana (VIH). De hecho la mayor mortalidad actual de estos pacientes se debe a estas infecciones.
Actualmente y desde los años noventa, el tratamiento de la enfermedad consiste en la infusión de factor VIII o factor IX recombinantes (fabricados artificialmente), libres por tanto de cualquier infección por virus.
El tratamiento se puede administrar tanto en respuesta a un episodio de sangrado como crónicamente, para prevenir sangrados.
Otros tratamientos
Los portadores (mujeres con un cromosoma X alterado y el otro normal) tienen habitualmente una concentración de factor que es la mitad de la normal. Esta cantidad debería ser suficiente para que no se produzca ningún problema de sangrado. Sin embargo existe mucha variabilidad en la actividad residual entre unas portadoras y otras. Por ello, actualmente se recomienda determinar la cantidad de factor para ver si existe algún riesgo de sangrado y prevenirlo ante determinadas circunstancias, por ejemplo intervenciones quirúrgicas.
Afecta a 1 de cada 10.000 varones de la población.
¿Cuáles son las causas de las hemofilias?
La hemofilia es una enfermedad hereditaria recesiva ligada al cromosoma X, es decir, el defecto genético se localiza en el cromosoma X. Dado que los varones (XY) solo tienen un cromosoma X, siempre desarrollarán la enfermedad si reciben de su madre un cromosoma X alterado. Por el contrario, si las mujeres (XX), reciben un único cromosoma X alterado (de su padre o de su madre) se convierten en portadoras pero no desarrollan la enfermedad. Si recibieran 2 cromosomas X alterados (uno del padre y otro de la madre) sí podrían desarrollar una hemofilia. Por este motivo la hemofilia es mucho más frecuente en los varones. Existen varios tipos de hemofilia:
- Hemofilia A o clásica. Se debe a una mutación en un gen llamado F8, responsable de la fabricación del factor VIII de la coagulación. Representa el 80% de los casos de hemofilia. En 3 de cada 10 casos no existen antecedentes de la enfermedad en la familia y se debe a que la madre es la primera persona que desarrolla la mutación. Se han descrito cientos de mutaciones diferentes en el gen F8.
- Hemofilia B. Se debe a una mutación en el gen F9, encargado de la fabricación del factor IX de la coagulación. También se han descrito cientos de mutaciones distintas en este gen.
¿Qué síntomas produce la enfermedad?
Los síntomas de la hemofilia A y de la hemofilia B son indistinguibles. En función del tipo de mutación, la actividad residual de los factores VIII o IX puede ser mayor o menor. En este sentido la hemofilia puede clasificarse como:
- Grave. Si la actividad residual del factor de coagulación es menor del 1%.
- Moderada. Si la actividad residual del factor de coagulación es del 1 al 5%.
- Leve. Si la actividad residual del factor de coagulación es del 6 al 30%.
- El interior de las articulaciones (hemartrosis). Las hemartrosis pueden aparecer desde el momento en el que el niño comienza a desplazarse (gatear o andar). Suelen aparecer en las rodillas, codos, hombros, caderas y tobillos. Producen hinchazón de la articulación junto a calor local y dolor intenso. Para evitar el dolor el paciente suele adoptar una determinada posición fija que favorece el desarrollo de contracturas musculares. En los niños puede que solo se observe irritabilidad y ausencia de movimiento de una articulación. El sangrado de una articulación favorece nuevos episodios de sangrado en la misma articulación, lo que conduce a un deterioro progresivo de la misma y produce deformaciones graves.
- En el interior de los músculos ante mínimos traumatismos e incluso de forma espontánea. La aparición de hematomas en los músculos puede comprimir los nervios, las arterias o las venas que pasan por la zona, lo que puede producir complicaciones añadidas.
- En el cerebro (hemorragia intracerebral).
- En la parte de debajo de la espalda, una zona llamada retroperitoneo. El sangrado en esta zona es peligroso dado que puede contener una gran cantidad de sangre y no producir síntomas hasta que el paciente entra en shock por pérdida de sangre.
- En la boca o en la garganta, lo que puede producir problemas para respirar.
- Sangrado por la orina (hematuria).
- En los huesos, produciendo zonas que asemejan a un tumor y son, en realidad, colecciones de sangre.
- Hemorragias tras intervenciones quirúrgicas.
¿Cómo se diagnostican las enfermedades de este tipo?
La hemofilia se sospecha ante la presencia de alteraciones en la coagulación de la sangre al realizar pruebas rutinarias de coagulación (alargamiento del tiempo parcial de tromboplastina activado). Ante esos hallazgos se deben solicitar pruebas más complejas que evalúen la actividad de los factores VIII y IX de la coagulación.
¿Es hereditaria la hemofilia?
La hemofilia es una enfermedad hereditaria recesiva ligada al cromosoma X. Esto significa que la padecen fundamentalmente los varones. Las mujeres solo pueden padecerla si heredan dos cromosomas X alterados (uno de la madre y otro del padre).
Un padre con hemofilia no trasmite nunca la enfermedad a sus hijos varones pero todas sus hijas serán portadoras de la enfermedad.
Una madre portadora del gen de la hemofilia transmitirá la hemofilia a la mitad de sus hijos varones y la mitad de sus hijas serán portadoras de la enfermedad.
¿Estas enfermedades hereditarias son contagiosas?
La hemofilia no es una enfermedad contagiosa.
¿Puede prevenirse la enfermedad?
La identificación de múltiples mutaciones en los genes F8 y F9 permite estudiar qué mujeres de la familia son portadoras de la enfermedad y realizar recomendaciones en consecuencia.
¿Cuál es el pronóstico de los afectados?
El pronóstico de los pacientes con hemofilia ha mejorado mucho en las últimas décadas. Sin embargo, y como consecuencia de la administración de crioprecipitados procedentes de plasma humano hasta finales de los años 80, actualmente muchos pacientes están infectados por el VIH o por el virus de la hepatitis C, lo que influye de forma sustancial en su pronóstico. Las expectativas de vida en pacientes no infectados son discretamente menores a las de la población general si tienen formas graves de la enfermedad. En casos de enfermedad leve o moderada sus expectativas de vida no difieren de las de la población normal. Los pacientes con hemofilia padecen con frecuencia problemas degenerativos en las articulaciones, lo que conlleva dolor e invalidez.
¿Cuál es el tratamiento de la hemofilia?
Sin tratamiento, la hemofilia grave tiene un mal pronóstico.
Los primeros tratamientos consistieron en la infusión de plasma (es decir de sangre tras quitarle las células que viajan en ella) o de concentrados del plasma (crioprecipitados) obtenidos de donantes sanos. Estos tratamientos, sin embargo, fueron una fuente frecuente de infección tanto por el virus de la hepatitis C como por el virus de la inmunodeficiencia humana (VIH). De hecho la mayor mortalidad actual de estos pacientes se debe a estas infecciones.
Actualmente y desde los años noventa, el tratamiento de la enfermedad consiste en la infusión de factor VIII o factor IX recombinantes (fabricados artificialmente), libres por tanto de cualquier infección por virus.
El tratamiento se puede administrar tanto en respuesta a un episodio de sangrado como crónicamente, para prevenir sangrados.
- Tratamiento profiláctico, de prevención. Se administra para mantener una concentración constante en sangre del factor deficiente por encima del 1%. Esto requiere infusiones 3 días por semana de factor VIII o dos días por semana de factor IX. Esta forma de tratamiento preventivo permite alcanzar la pubertad sin alteraciones en las articulaciones.
- Tratamiento preventivo ante cirugías. La cantidad de factor a administrar y los días que va a mantenerse dependen del tipo de cirugía. En general se intenta llevar la actividad del factor al 100%.
- Tratamiento cuando haya sangrado. Este tratamiento se debe de iniciar de forma inmediata al sospechar un sangrado, antes incluso de realizarse pruebas que efectivamente objetiven que se está sangrando. El factor deficitario se puede administrar mediante infusión continua o mediante inyecciones cada 12 horas (factor VIII) o una vez al día (factor IX). En función de la gravedad del sangrado se intentará elevar la actividad del factor en sangre por encima de un determinado valor y deberá mantenerse una actividad residual determinada durante los días posteriores, de nuevo más o menos días en función de la gravedad del sangrado. La cantidad de factor a administrar para alcanzar una determinada actividad del mismo en sangre puede calcularse en función del peso y de los valores basales mediante fórmulas sencillas.
- Controlar los episodios de sangrado. Los pacientes poco respondedores, es decir con pocos anticuerpos, responden bien al incrementar la cantidad de factor que se administra. Los muy respondedores precisan la inyección de múltiples factores de la coagulación a la vez, o de concentrado de factor VIIa.
- Intentar hacer desaparecer los anticuerpos. Mediante inmunotolerancia, inyectando todos los días una cantidad del factor que falta hasta que desaparecen los anticuerpos. Al año suele haber desaparecido el anticuerpo en un 60% de los sujetos.
Otros tratamientos
- DDAVP. Vasopresina sintética. Eleva transitoriamente la concentración de factor VIII pero no de factor IX. En sujetos con formas leves o moderadas de la enfermedad se debe evaluar si el paciente tiene o no una buena respuesta a este tratamiento. No tiene utilidad en las formas graves de la enfermedad.
- Antifibrinolíticos (ácido ε-aminocaproico y ácido tranexámico). Se deben utilizar localmente para favorecer la interrupción del sangrado producido en encías, cirugía oral o aparato digestivo. Se usa durante una semana.
Portadores
Los portadores (mujeres con un cromosoma X alterado y el otro normal) tienen habitualmente una concentración de factor que es la mitad de la normal. Esta cantidad debería ser suficiente para que no se produzca ningún problema de sangrado. Sin embargo existe mucha variabilidad en la actividad residual entre unas portadoras y otras. Por ello, actualmente se recomienda determinar la cantidad de factor para ver si existe algún riesgo de sangrado y prevenirlo ante determinadas circunstancias, por ejemplo intervenciones quirúrgicas.
Aunque esta información ha sido redactada por un especialista médico, su edición ha sido llevada a cabo por periodistas, por lo que es un contenido meramente orientativo y sin valor de indicación terapéutica ni diagnóstica. Recomendamos al lector/a que cualquier duda relacionada con la salud la consulte directamente con el profesional del ámbito sanitario correspondiente.

 Andalucía
Andalucía  Cataluña
Cataluña  Madrid
Madrid  C. Valenciana
C. Valenciana  Galicia
Galicia  Castilla y León
Castilla y León  País Vasco
País Vasco  Canarias
Canarias  C-La Mancha
C-La Mancha  Murcia
Murcia  Aragón
Aragón  Extremadura
Extremadura  Asturias
Asturias  Baleares
Baleares  Navarra
Navarra  Cantabria
Cantabria  La Rioja
La Rioja 
