Pasi A. Jänne, del Instituto del Cáncer Dana-Farber.
Takeda ha anunciado nuevos datos del ensayo de Fase 1/2 de
mobocertinib (TAK-788) administrado por vía oral en pacientes con
cáncer de pulmón no microcítico metastásico (CPNMm) con mutaciones de inserción en el exón 20 del EGFR (receptor del factor de crecimiento epidérmico) previamente tratados.
Estos resultados fueron presentados en una sesión oral en la
Conferencia Mundial sobre el Cáncer de Pulmón (WCLC) de la
Asociación Internacional para el Estudio del Cáncer de Pulmón (IASLC).
mobocertinib, "respuestas clínicamente significativas"
“Los resultados muestran que mobocertinib proporcionó respuestas clínicamente significativas y que la duración de las mismas fue notable en pacientes con CPNMm con mutaciones de inserción en el exón 20 del EGFR que habían recibido previamente un tratamiento basado platino”, ha declarado
Pasi A. Jänne, del Instituto del Cáncer Dana-Farber.
“Estos datos son prometedores y aportan más datos de mobocertinib como un posible tratamiento oral para los pacientes con CPNMm con mutaciones de inserción en el exón 20 del EGFR, los cuales
precisan urgentemente opciones terapéuticas más específicas".
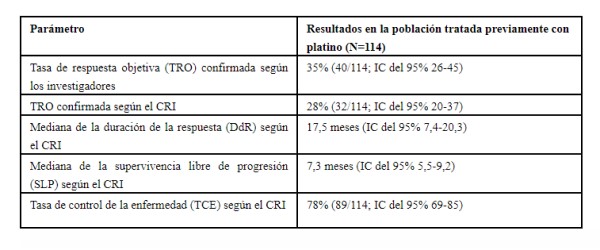
En el análisis se incluyó a pacientes con CPNMm con mutaciones de inserción en el exón 20 del EGFR del ensayo de fase 1/2 que habían recibido previamente tratamiento basado en platino. Todos los pacientes fueron tratados con mobocertinib oral a una dosis de 160 mg una vez al día.
Los resultados principales obtenidos en esta población fueron los siguientes:
Perfil de seguridad
El perfil de seguridad observado fue controlable, informa Takeda. Los acontecimientos adversos relacionados con el tratamiento (AART) más frecuentes (incidencia ≥ 20%) en los pacientes tratados previamente con platino registrados en mayo como fecha de corte fueron: diarrea (90%), erupción cutánea (45%), paroniquia (34%), náuseas (32%), disminución del apetito (32%), piel seca (30%) y vómitos (30%). Los AART de grado ≥3 con una incidencia ≥5% fue diarrea (21%). Diecinueve pacientes (17%) suspendieron el tratamiento debido a AA, sobre todo por diarrea (4%) y náuseas (4%). El perfil de seguridad observado en la fecha de corte de los datos en noviembre fue coherente con el registrado en la fecha de corte de los datos en mayo.
No existen aún tratamientos específicos aprobados
“La importancia de avanzar en la investigación para las personas con CPNMm con mutaciones de inserción en el exón 20 del EGFR, una
enfermedad compleja y devastadora para la que no existen tratamientos específicos aprobados, no se puede subestimar, ya que las opciones terapéuticas existentes proporcionan un beneficio limitado y los resultados de supervivencia de los pacientes suelen ser malos”, señala
Christopher Arendt, director del área terapéutica de Oncología de Takeda.
“Estamos orgullosos de estos resultados positivos de mobocertinib, el
primer medicamento oral diseñado para tratar específicamente esta enfermedad, y estamos deseando presentar los datos del análisis de la población tratada previamente con platino a la
Food and Drug Administration (FDA) de Estados Unidos y a las autoridades sanitarias de otros países".
Actualmente, mobocertinib no está aprobado para el CPNMm mutaciones de inserción en el exón 20 del EGFR
Acerca del ensayo de Fase 1/2
El objetivo del ensayo de Fase 1/2 es evaluar la seguridad, la farmacocinética y la actividad antitumoral de mobocertinib oral en pacientes con cáncer de pulmón no microcítico (CPNM). El ensayo consta de una fase 1 de aumento escalonado de la dosis para evaluar mobocertinib en monoterapia y en combinación con quimioterapia y de una fase 2 de expansión con siete cohortes diferentes y una cohorte de extensión para investigar la actividad antitumoral de mobocertinib en las diversas poblaciones del ensayo.
En el análisis se incluyó a 114 pacientes con CPNMm con mutaciones de inserción en el exón 20 del EGFR de la fase de aumento escalonado de la dosis y de la fase de extensión del ensayo de fase 1/2 que habían recibido previamente un tratamiento con platino y que fueron tratados con mobocertinib oral a una dosis de 160 mg una vez al día.
La cohorte de extensión de la fase 2 del ensayo, conocida como EXCLAIM, estuvo compuesta por 96 pacientes con CPNMm con mutaciones de inserción en el exón 20 del EGFR tratados previamente que recibieron mobocertinib oral en una dosis de 160 mg una vez al día.
Acerca de mobocertinib (TAK-788)
Mobocertinib, un medicamento que se administra por vía oral, es un potente inhibidor de la tirosina quinasa (TKI) de molécula pequeña, diseñado específicamente para actuar selectivamente sobre las mutaciones de inserción en el exón 20 del receptor del factor de crecimiento epidérmico (EGFR).
- En 2019 la FDA de Estados Unidos concedió a mobocertinib la designación de
medicamento huérfano para el tratamiento del cáncer de pulmón con mutaciones en el (HER2) o con mutaciones en el EGFR, incluidas las mutaciones por inserción en el exón 20.
- En abril de 2020 la FDA concedió a mobocertinib la designación de tratamiento innovador para pacientes con cáncer de pulmón no microcítico metastásico (CPNMm) con mutaciones de inserción en el exón 20 del EGFR cuya enfermedad ha progresado durante o después de la quimioterapia con platino.
- En octubre de 2020 el
Centro de Revisión de Medicamentos (CDE) de China concedió a mobocertinib la designación de tratamiento innovador para la misma indicación.
Acerca del CPNMm con inserción+ del exón 20 del EGFR
El cáncer de pulmón no microcítico (CPNM) es la forma más común de cáncer de pulmón y representa aproximadamente el 85% de los 1,8 millones de nuevos casos de cáncer de pulmón que se diagnostican cada año en el mundo, según estimaciones de la
Organización Mundial de la Salud.
Los pacientes con CPNM metastásico (CPNMm) con inserción en el exon 20 del receptor del factor de crecimiento epidérmico (EGFR) representan aproximadamente el 1%-2% de los pacientes con CPNM y esta enfermedad es más común en las poblaciones asiáticas que en las poblaciones occidentales.
El pronóstico de esta enfermedad es peor que el de otras enfermedades con mutaciones en el EGFR, porque actualmente no hay ningún tratamiento aprobado por la FDA para las inserciones del exón 20 y los tratamientos actuales con inhibidores de la tirosina quinasa del EGFR y con quimioterapia proporcionan beneficios limitados a estos pacientes, ha señalado Takeda en una nota remitida a este diario.
Las informaciones publicadas en Redacción Médica contienen afirmaciones, datos y declaraciones procedentes de instituciones oficiales y profesionales sanitarios. No obstante, ante cualquier duda relacionada con su salud, consulte con su especialista sanitario correspondiente.