Redacción. Madrid
La Agencia Europea del Medicamento (EMA, en sus siglas en inglés) ha publicado su programa de trabajo para 2014, en el que los desarrollos legislativos ocuparán un lugar central y, de ellos, se prestará especial atención a la farmacovigilancia, cuya normativa a nivel continental entró en vigor en julio de 2012 y es uno de los mayores cambios en el marco legal de la Agencia desde su fundación en 1995.
La implementación de la normativa europea de farmacovigilancia continuará siendo, por tanto, uno de los principales objetivos. A esto se suma el refuerzo de las funcionalidades de EudraVigilance, la base de datos europea sobre reacciones adversas a medicamentos y un sistema de seguimiento de la literatura científica.
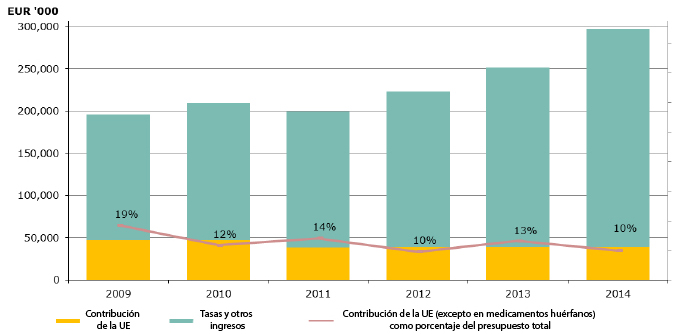
Evolución de los ingresos de la Agencia Europea. Fuente: EMA.
|
Precisamente, varias asociaciones europeas representantes de la industria farmacéutica (Efpia, EGA y EuropaBio, entre otras) se quejaron hace poco por la poca transparencia en el cálculo de los costes asociados a la nueva legislación de farmacovigilancia y pidieron que los países miembros de la UE se hicieran cargo de parte del incremento de tasas.
También continuará la implantación de la directiva sobre falsificación de medicamentos, que entró en vigor el año pasado, y el seguimiento y contribución con nuevas propuestas legislativas para la realización de ensayos clínicos.
La Agencia también señala como uno de sus principales puntos de trabajo el énfasis en el apoyo a las primeras etapas de desarrollo de los medicamentos, como forma de que los nuevos fármacos lleguen antes a los pacientes.
Por último, la comunicación también formará parte del eje estratégico de la EMA durante 2014. A lo largo del año lanzará su política de publicación de datos clínicos, lo que complementará otras iniciativas como el acceso a datos de seguridad de los fármacos, publicaciones de declaraciones de interés y currículos de los expertos, miembros del comité y directivos.
ENLACES RELACIONADOS:
Acceda al documento de la EMA
La Aemps actualiza los protocolos de implementación de las decisiones de farmacovigilancia de la EMA (19/03/2014)
La industria del medicamento reclama transparencia a la EMA (24/02/2014)
Las informaciones publicadas en Redacción Médica contienen afirmaciones, datos y declaraciones procedentes de instituciones oficiales y profesionales sanitarios. No obstante, ante cualquier duda relacionada con su salud, consulte con su especialista sanitario correspondiente.
