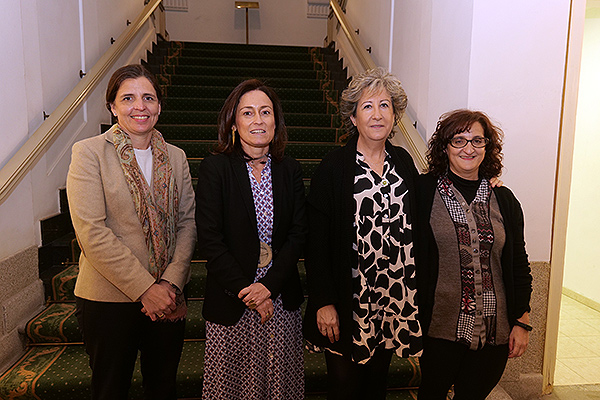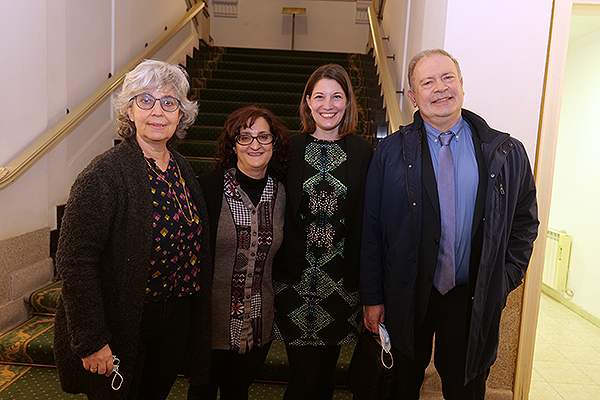Este martes se ha presentado la '
Guía de Excelencia para la realización de ensayos clínicos en la Farmacia Hospitalaria'. Este documento representa "una oportunidad para que los pacientes puedan acceder a las
distintas posibilidades terapéuticas, para los profesionales y para los sistemas sanitarios". Así lo ha anunciado
Javier Urzaiz, subdirector general de
Farmaindustria, en el acto de presentación de la guía celebrado en la Real Academia de Farmacia (
RANF).
En este mismo sentido,
Olga Delgado, presidenta de la Sociedad Española de Farmacia Hospitalaria (
SEFH), ha lanzado un mensaje claro: "Los
farmacéuticos de hospital necesitamos a la industria farmacéutica para que nos apoyen como elemento clave investigador". El principal objetivo de esta guía, según Delgado, "es lograr la excelencia en el campo de los ensayos clínicos en la Farmacia Hospitalaria y, por ello, tenemos que fomentar la participación del farmacéutico hospitalario".
Por su parte, para
Jesús Aguilar, presidente del Consejo General de Colegios Oficiales de Farmacéuticos (
Cgcof), ha recalcado que "esta guía es la esperanza para muchos pacientes que no tienen ninguna opción terapéutica y las complejidades de esas diferentes patologías hace que
fomentar la I+D en los ensayos clínicos sea indispensable".
Estructura de la Guía de Excelencia de ensayos clínicos
La Guía de Excelencia tiene una estructura que se divide en tres ejes principales:
-
Visita pre-estudio
-
Visita de inicio
-
Ejecución y cierre de ensayo
A este respecto,
Araceli Parra, responsable de Calidad y Formación de Ensayos Clínicos de
Roche, explica que, en el caso de la 'visita pre-estudio', el reto principal es conocer los aspectos generales del funcionamiento de los distintos Servicios de
Farmacia Hospitalaria". Por todo ello, Parra asegura que "estos servicios deben disponer de la información del
medicamento en investigación (MI), sobre todo si hay terapias novedosas o preparaciones complejas".
En cuanto a la segunda etapa, la 'visita de inicio', Parra aclara que "el
investigador princpal (IP) debe fomentar la comunicación y delegación con el servicio de Farmacia Hospitalaria (SF) en cuanto al
manejo de la medicación, además de determinar los distintos canales de comunicación entre el equipo investigador y el SF".
Y, respecto a la ejecución y cierre de ensayo,
Pilar Suñé, coordinadora del Grupo de Trabajo de Ensayos Clínicos de la SEFH y adjunta del Servicio de Farmacia Hospitalaria del Hospital Universitari Vall d'Hebron, detalla que "en ella se abordan los puntos susceptibles de
mejora en los ensayos clínicos".
Asimismo, Suñé declara que, en esta última etapa, "se deben establecer una serie de procedimientos para la correcta implementación de los cambios en el protocolo y en el
manejo del MI, así como optimizar el manejo de las incidencias". Por todo ello, Suñé recalca que "la excelencia es un procedimiento y necesita muchos
recursos para tener a los mejores profesionales disponibles".
15 servicios de Farmacia Hospitalaria y 12 farmacéuticas
En la presentación de la Guía, también han participado
Amelia Martín Uranga, directora asociada de Investigación Clínica y Traslacional de Farmaindustria; y
Ana Herranz, vocal de Farmacia Hospitalaria del Cgcof. Ambas han recalcado que "se trata de un documento en el que han colaborado un total de 15 Servicios de Farmacia Hospitalaria y 12 compañías farmacéuticas".
Finalmente, para cerrar el evento ha participado el presidente de la Sociedad Española de Directivos de la Salud (
Sedisa),
José Soto Bone, quien ha declarado que "hay que dar opciones terapéuticas para que el mundo tenga experanza y mejore. Por ello, invertir en investigación de ensayos clínicos significa más y mejor vida".
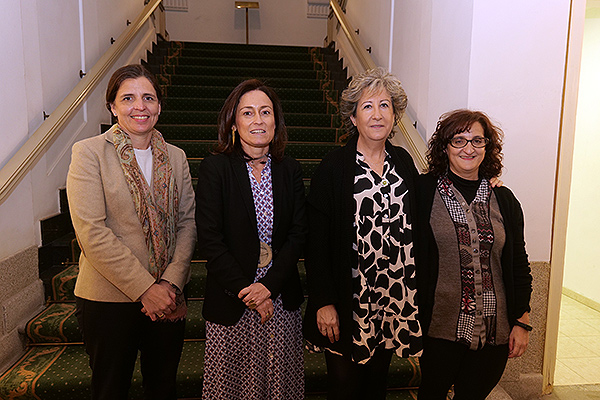
Ana Herranz, vocal de Farmacia Hospitalaria del Consejo General de Colegios Oficiales de Farmacéuticos; Amelia Martín, directora asociada de Investigación Clínica y Traslacional Farmaindustria; Araceli Parra, responsable de Calidad y Formación de Ensayos Clínicos de Roche; Pilar Suñé, coordinadora del Grupo de Trabajo de Ensayos Clínicos de la SEFH.
|

Roberto Collado, farmacéutico hospitalario del Gregorio Marañon ; Javier Urzay, subdirector general de Farmaindustria; José Ramón Luis-Yagüe, director del departamento de relaciones conla CCAA en Farmaindustria.
|
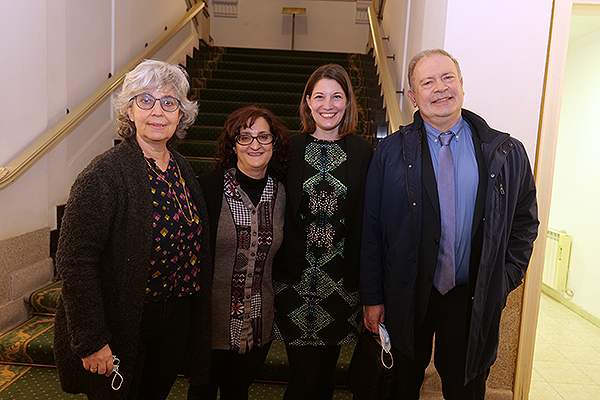
Ana Ferrer, farmacéutica hospitalaria del Hospital de Bellvitge; Pilar Suñé; Cristina Gónzalez Pérez, farmacéutica hospitalaria del Clínico San Carlos; Jose Manuel Carretero, farmacéutico hospitalario del Hospital Virgen Macarena.
|

José Ramón Luis-Yagüe, Ana Herranz, Javier Urzay, Jesús Aguilar, Roberto Collado y Emili Esteve, director del Departamento Técnico de Farmaindustria.
|

Ángel Mª Villar, Emili Esteve y Antonio Doadrio, presidente de la RANF.
|

Jesús Aguilar, presidente del Consejo General de Clegios Oficiales de Farmacéuticos (CGCOF).
|

Amelia Martín Uranga, directora asociada de Investigación Clínica y Traslacional de Farmaindustria.
|

Ana Herran durante la presentación de la Guía.
|

Araceli Parra, responsable de Calidad y Formación de Ensayos Clínicos de Roche.
|

Pilar Suñé durante su presentación de la estructura de la Guía
|

José Soto Bonel, presidente de la Sociedad Española de Directivos de la Salud (Sedisa).
|

Jesús Aquilar, Ángel Mª Villar y Javier Urzay en la inauguración del acto.
|