Eduardo Ortega Socorro. Madrid
Uno de los últimos reales decreto aprobados por el Gobierno de Mariano Rajoy (ante quedar bajo la denominación de ‘en funciones’), fue el 1090/2015 del 4 diciembre, por el que se regulan los, por el que se regulan los ensayos clínicos con medicamentos, los Comités de Ética de la Investigación con medicamentos y el Registro Español de Estudios Clínicos.
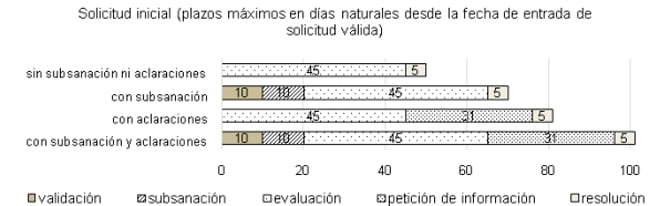
Plazos para la autorización de los ensayos clínicos en España. Fuente: Aemps.
|
Se trata de una normativa que viene a adaptar la normativa europea respecto a ensayos recientemente reformada (con el objetivo de optimizar los plazos y mejorar la transparencia de la información de la investigación clínica en el viejo continente, y que no estará en funcionamiento hasta 2017/2018) y que ha entrado en vigor justo este miércoles 13 de enero de 2016.
Precisamente para aclarar su contenido, la Agencia Española de Medicamentos y Productos Sanitarios (Aemps) ha lanzado un documento en el que se explicita a qué órgano se han de pedir las autorizaciones para realizar un ensayo clínico y cuáles son los plazos. Concretamente, el máximo de tiempo que pueden tardar las Administraciones Públicas son unos 101 días, y ello con subsanaciones y aclaraciones de por medio. En caso de no haber complicaciones, el plazo debería ser de unos 50 días naturales.
Asimismo, el órgano aclara que los Comités Éticos de Investigación Clínica (CEIC) acreditados podrán asumir las responsabilidades que el real decreto establece para los Comités de Ética de la Investigación con Medicamentos (CEIm) hasta que tenga lugar su reacreditación conforme a lo dispuesto en la disposición adicional primera del nuevo real decreto.
El promotor podrá elegir el CEIm entre los CEIC acreditados, que figurarán en la página web de la Aemps. Asimismo, las solicitudes deben presentarse con firma electrónica y de forma simultánea a la Aemps y al CEIm correspondientes.
Por otro lado, también se explicita que “el promotor es responsable de suministrar de forma gratuita los medicamentos en investigación. En los ensayos clínicos cuyo promotor sea un investigador del centro o una entidad no lucrativa de carácter científico, o en aquellos en los que exista común acuerdo con la dirección del centro donde vaya a desarrollarse el ensayo clínico, se podrán acordar con el centro otras formas de suministro, especialmente cuando el tratamiento de los pacientes en el ensayo, o parte de él, fuera el que recibirían en caso de haber decidido no participar en el ensayo. En todo caso, deberá asegurar que la participación de un sujeto en el ensayo clínico no supondrá un coste” adcional.
ENLACES RELACIONADOS
Acceda al documento de la Aemps
Un solo comité validará los ensayos clínicos (04/12/15)
Las informaciones publicadas en Redacción Médica contienen afirmaciones, datos y declaraciones procedentes de instituciones oficiales y profesionales sanitarios. No obstante, ante cualquier duda relacionada con su salud, consulte con su especialista sanitario correspondiente.
 Andalucía
Andalucía  Cataluña
Cataluña  Madrid
Madrid  C. Valenciana
C. Valenciana  Galicia
Galicia  Castilla y León
Castilla y León  País Vasco
País Vasco  Canarias
Canarias  C-La Mancha
C-La Mancha  Murcia
Murcia  Aragón
Aragón  Extremadura
Extremadura  Asturias
Asturias  Baleares
Baleares  Navarra
Navarra  Cantabria
Cantabria  La Rioja
La Rioja 


